Il processo di trasformazione delle olive fermentate è la risultante di complesse reazioni biochimiche, determinate dall’interazione del microbiota indigeno delle olive con le caratteristiche di composizione della salamoia di fermentazione e con l’ambiente di lavorazione. Uno degli aspetti più rilevanti nella trasformazione delle olive da tavola è il processo di deamarizzazione, che ha lo scopo principale di diminuire o rimuovere del tutto il naturale sapore amaro dell’oliva. Questo processo avviene attraverso l’idrolisi dei composti responsabili del sapore amaro del frutto, primo fra tutti il glucoside oleuropeina, dotato altresì di azione antimicrobica.
Criticità in fermentazione
I due principali metodi di fermentazione sono quello Spagnolo (o Sivigliano) e quello Greco: il primo, largamente diffuso anche in Italia, si basa su una deamarizzazione chimica del frutto che consiste essenzialmente nell’aggiunta di soluzioni alcaline.

Il metodo Greco consiste, invece, in una deamarizzazione biologica compiuta da batteri lattici, cresciuti spontaneamente nel mezzo (salamoia). Tale processo è fortemente influenzato dalla cultivar, dal microbiota indigeno, da fattori intrinseci come pH, acqua libera (aw), concentrazione di sale della salamoia, disponibilità di nutrienti e di ossigeno, concentrazione di composti antimicrobici (es. oleuropeina e verbascoside) e da fattori estrinseci come tempo e temperatura di fermentazione. Pertanto, in caso di mancato controllo dei suddetti fattori, possono instaurarsi fenomeni di deterioramento come formazione di sacche d’aria (gaspocket), rammollimenti, rotture della cuticola e altri difetti.
Tuttavia, al fine di ottenere un processo di fermentazione più controllato e prevedibile, si può ricorrere all’impiego di colture starter. Un appropriato inoculo, infatti, previene i fenomeni di spoilage da parte di microrganismi alteranti, inibisce la crescita di patogeni e garantisce un processo maggiormente controllabile e quindi un prodotto di alta qualità, standardizzato e ripetibile, e privo di difetti.
Selezione dei microrganismi
I ceppi con maggiori potenzialità per l’impiego come colture starter nella fermentazione delle olive da tavola appartengono alle specie Lactobacillus plantarum e Lactobacillus pentosus, microrganismi dotati di elevata capacità acidificante ed attività oleuropeinolitica, e alla specie Enterococcus casseliflavus.
In riferimento a colture starter miste, studi sperimentali recenti hanno considerato la combinazione di L. pentosus con ceppi di Enterococchi in grado di avviare la fermentazione anche a valori di pH alcalini (circa 9) dopo il trattamento con soda; ciò potrebbe permettere di ridurre il numero dei lavaggi preliminari alla fermentazione. Quest’ultimo aspetto ha anche interessanti ricadute ambientali, consentendo una diminuzione dei reflui inquinanti contenenti soda.
Le caratteristiche fondamentali di una coltura starter per la fermentazione delle olive sono:
- metabolismo omofermentante;
- sviluppo rapido;
- capacità di crescere anche a basse temperature;
- capacità aromatizzante;
- scarse richieste di fattori di crescita;
- attività antimicrobica; produzione di acidi organici;
- tolleranza al sale e all’acidità;
- capacità di tollerare e/o idrolizzare le sostanze fenoliche (es. oleuropeina).
Un’altra importante caratteristica delle colture starter è la loro capacità di dominare sul microbiota indigeno. La capacità delle colture starter di dominare potrebbe essere legata alla capacità di crescita predominante in condizioni di fermentazione e/o all’abilità di produrre sostanze antagoniste.
L’uso di ceppi selezionati come colture starter permette una sensibile riduzione della durata del processo di deamarizzazione, accompagnata da un miglioramento della qualità del prodotto finale dal punto di vista sensoriale, reologico e di sicurezza alimentare consentendo di superare le problematiche dei processi spontanei.
Sperimentazioni con L. pentosus
Nello studio che presentiamo è stata impiegata una miscela di due ceppi di L. pentosus, identificati e caratterizzati nel corso di diversi progetti di ricerca, validati in fermentazioni su scala di laboratorio e industriale, impiegando olive da tavola di diverse cultivar e oggetto di un recente brevetto (n. 0001428559, v. nel riquadro “Il brevetto”).
Le olive sono state immediatamente lavate e poste in una salamoia al 6% di NaCl. Tutte le fermentazioni sono state eseguite ad una temperatura costante di 20 °C (foto 1). Dopo una settimana, i campioni sono stati inoculati con una miscela, costituita dai due ceppi di L. pentosus, (LP1 e LP2) alla concentrazione finale di 106 Ufc/ml (Unità formanti colonie per ml). Fermentazioni non inoculate sono state utilizzate come controllo negativo.
Le fermentazioni, condotte su scala industriale, sono state monitorate a 7, 15, 30 giorni, mediante determinazione del pH, evoluzione del contenuto dell’oleuropeina e analisi microbiologiche. Il pH è stato determinato sui campioni di olive e salamoie mediante pHmetro: l’analisi è stata condotta dopo diluizione (1: 2 p/v) del campione in acqua deionizzata ed idonea dispersione operata mediante omogeneizzatore. Il contenuto di oleuropeina è stato determinato mediante Hplc in accordo con Servili et al. (2006).
Al fine di determinare le popolazioni microbiche che caratterizzano le olive fermentate sono stati effettuati campionamenti sulle salamoie all’inizio della fermentazione (T0) e a fine fermentazione.
Aliquote di 10 mL di salamoie sono state sospese in 90 mL di soluzione fisiologica sterile (0,85% p/v NaCl) ed omogeneizzate con Stomacher Lab-Blender 400 per 2 minuti. Sono state quindi allestite diluizioni seriali in acqua peptonata sterile (peptone 10 g/l e NaCl 5 g/l). I gruppi microbici sono stati determinati utilizzando i seguenti substrati:
- carica mesofila aerobia (CMA) (Plate Count agar) a 30 °C per 48 h;
- lattobacilli mesofili (LAB) (MRS agar acidificato a pH 5,4 con acido acetico) a 30 °C per 72 h in condizioni di anaerobiosi;
- lieviti (YPD agar, 1%, estratto di lievito, 2% peptone, 2% glucosio, 2% agar con aggiunta di 150 ppm di cloramfenicolo) a 30 °C per 48 h;
- infine Enterobacteriaceae (Violet Red Bile agar) a 37 °C per 24 h.
Valutazione dei risultati
Il pH della salamoia è considerato il principale indicatore dell’andamento della fermentazione. Il pH iniziale delle salamoie presentava un valore intorno a 5 sia nei campioni inoculati che nei controlli. Nei giorni successivi si è osservato un decremento del pH come mostrato nel grafico 1.
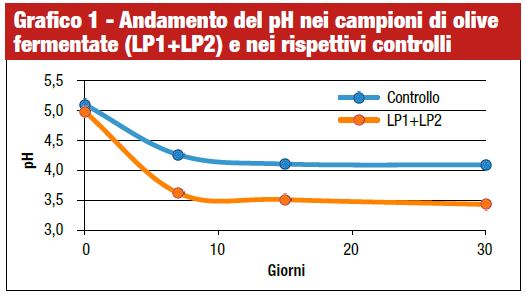
Nei campioni inoculati il pH ha subito una maggiore riduzione raggiungendo valori di circa 3,6 già dopo 7 giorni ed un valore di 3,4 a fine fermentazione. Nei controlli, invece, il pH a fine fermentazione era più alto e nell’ordine di 4,09. L’abbassamento del pH in tempi molto brevi è importante in relazione all’effetto inibente nei confronti di microrganismi patogeni ed alteranti ed è fortemente influenzato dai microrganismi prevalenti durante la fermentazione.
In un recente lavoro, Hurtado et al. (2010) hanno osservato una rapida e costante acidificazione della salamoia inoculata con il ceppo L. pentosus 5E3A18. Un simile andamento è stato osservato anche se il ceppo era coinoculato con il L. pentosus V10A2. Quest’ultimo ceppo, inoculato singolarmente, nelle stesse condizioni, non era in grado di consentire la stessa cinetica di acidificazione, a conferma della necessità di un’attenta valutazione delle capacità fermentative di diversi ceppi in condizioni reali.
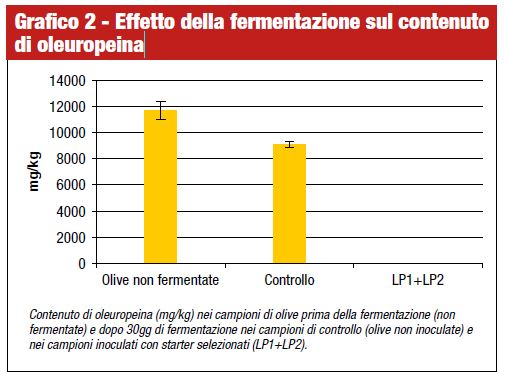
Nel nostro caso, la combinazione dei due starter ha influenzato il giusto andamento della fermentazione. Alla rapida attività acidificante, infatti, si è affiancata anche una rapida idrolisi dell’oleuropeina, utilizzata come marker per la valutazione dell’attività deamarizzante dello starter. Già dopo 30 giorni di fermentazione, in presenza della miscela di ceppi selezionati, l’oleuropeina era completamente idrolizzata, mentre nei controlli era presente ad una concentrazione pari a 9108 mg/kg (grafico 2).
Analisi microbiologiche
La fermentazione delle olive si caratterizza per un preciso susseguirsi di gruppi microbici. All’inizio della fermentazione prevalgono microrganismi aerobi, enterobatteri anaerobi facoltativi e muffe. Quando il pH diminuisce prendono il sopravvento i batteri lattici, inizialmente cocchi e poi lattobacilli, appartenenti ai generi Pediococcus, Enterococcus, Leuconostoc e Lactobacillus, rispettivamente. Questi ultimi divengono ben presto dominanti e persistono fino alla fine della fermentazione grazie alla loro capacità di sviluppare a bassi valori di pH. I lieviti, invece cominciano a crescere già nelle prime fasi di fermentazione e raggiungono la densità massima di popolazione dopo 10-25 giorni coesistendo per l’intero processo con i LAB.
La prevalenza di un gruppo microbico rispetto ad un altro dipende da diversi fattori tecnologici come concentrazione di sale, valore iniziale di pH, disponibilità di ossigeno, diffusione di nutrienti dalla drupa e temperatura di fermentazione (Tassou et al., 2002). Uno squilibrio tra i gruppi microbici può influenzare fortemente le caratteristiche organolettiche e fisicochimiche del prodotto finito.
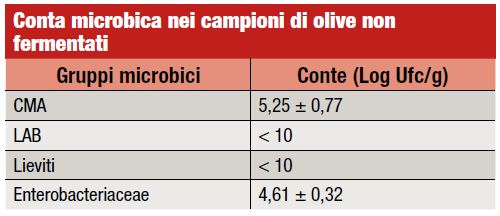
Nel corso della nostra ricerca, le analisi microbiologiche sono state eseguite sul campione di olive prima della fermentazione (T0) e su tutti i campioni di salamoia dopo 1, 7, 15 e 30 giorni dall’inoculo (Grafico 3 e tabella). Le olive non fermentate si caratterizzavano per la presenza di Enterobactericeae (4,61 log Ufc/g) e la CMA era pari a 5,25 log Ufc/g. Batteri lattici e lieviti erano inferiori a 10 log Ufc/g.
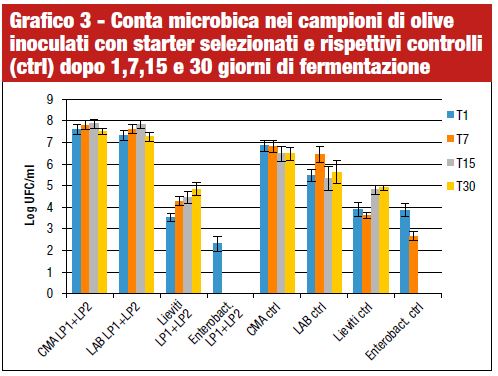
Nelle fermentazioni inoculate con gli starter e nei controlli i LAB erano i microrganismi dominanti, anche se nelle fermentazioni spontanee presentavano valori più bassi di 1–2 cicli logaritmici. Risultati simili sono stati ottenuti per la CMA. I lieviti erano presenti in concentrazione simile sia nei campioni inoculati che nei controlli e a fine fermentazione si attestavano intorno ai 4,8 log Ufc/ml. Le Enterobactericeae nei campioni inoculati erano assenti già dopo 7 giorni, mentre nelle fermentazioni spontanee sono stati determinati anche dopo 14 giorni di fermentazione, in accordo con il più lento decremento di pH osservato in questi campioni.
I risultati ottenuti in questo studio hanno evidenziato gli effetti positivi dell’impiego di microrganismi starter per migliorare la cinetica di fermentazione. Infatti il loro impiego permette un buon andamento del processo fermentativo e contemporaneamente una più rapida deamarizzazione delle olive. In generale, gli starter utilizzati hanno mostrato una elevata capacità di adattamento alla matrice, riuscendo a dominare il processo: caratteristica indispensabile per un microrganismo da utilizzare su scala industriale.
Il brevetto “Starter per la deamarizzazione biologica delle olive da mensa”
Nell’ambito di una sperimentazione finanziata da Unaprol, a cui hanno collaborato l’Unità di Ricerca (U.R.) di Microbiologia dell’Università di Teramo, coordinata dal Prof. Aldo Corsetti, e l’U.R. di Tecnologie Alimentari dell’Università di Perugia, coordinata dal Prof. Maurizio Servili, è stato realizzato il brevetto “Starter per la deamarizzazione biologica delle olive da mensa”. In particolare, dopo l’allestimento di un’ampia collezione di batteri lattici (oltre 300 ceppi), isolati dalla fermentazione spontanea di diverse cultivar di olive da mensa italiane, identificati e tipizzati con sistemi fenotipici e molecolari, sono state realizzate fermentazioni su scala di laboratorio per individuare la migliore combinazione tra ceppi.
Due di questi, appartenenti alla specie Lactobacillus pentosus, naturalmente predominante nel corso di fermentazioni spontanee, sono stati miscelati in appropriate concentrazioni e impiegati come starter per l’avvio di fermentazioni in salamoia, ottenendo la completa deamarizzazione biologica delle olive in un sistema di fermentazione al naturale, senza l’impiego di soda. Lo starter brevettato, di cui è titolare Unaprol, può rappresentare un importante ausilio tecnologico per il controllo della fermentazione delle olive da mensa, garantendo nel contempo sicurezza d’uso, ripetibilità e riconoscibilità delle produzioni, riduzione dei tempi di deamarizzazione in assenza di difetti.
di Giorgia Perpetuini, Roberta Prete, Natalia Garcia Gonzalez, Noemi Battistelli, Rosanna Tofalo e Aldo Corsetti
Leggi l’articolo su Olivo e Olio n. 3/2018 L’Edicola di Olivo e Olio










