La specie Resseliella oleisuga è stata descritta da Targioni Tozzetti nel 1885 come Diplosis oleisuga su materiale raccolto sulle colline fiorentine. Il Dittero appartenente al sottordine Nematocera e alla vasta famiglia Cecidomyiidae, fu successivamente assegnato dai differenti Autori ai generi Clinodiplosis, Thomasia, Thomasiniana e infine al taxon Resseliella dopo che Gagné nel 1973 aveva accertato la sinonimia fra Thomasiniana Strand, 1927, e Resseliella Seitner, 1906, genere che oggi in Europa conta, secondo Fauna Europea, 19 entità specifiche.
R. oleisuga è ritenuta di origine paleartica e a tutt’oggi risulta diffusa prevalentemente nelle regioni circummediterranee, più o meno strettamente associata al genere Olea e ad altre Oleaceae fra le quali Fraxinus e Phyllirea.
L’adulto del dittero è piccolo e delicato, misura 2-3 mm di lunghezza e come tutti i cecidomiidi ha occhi composti oloptici e apparato boccale lambente succhiante.
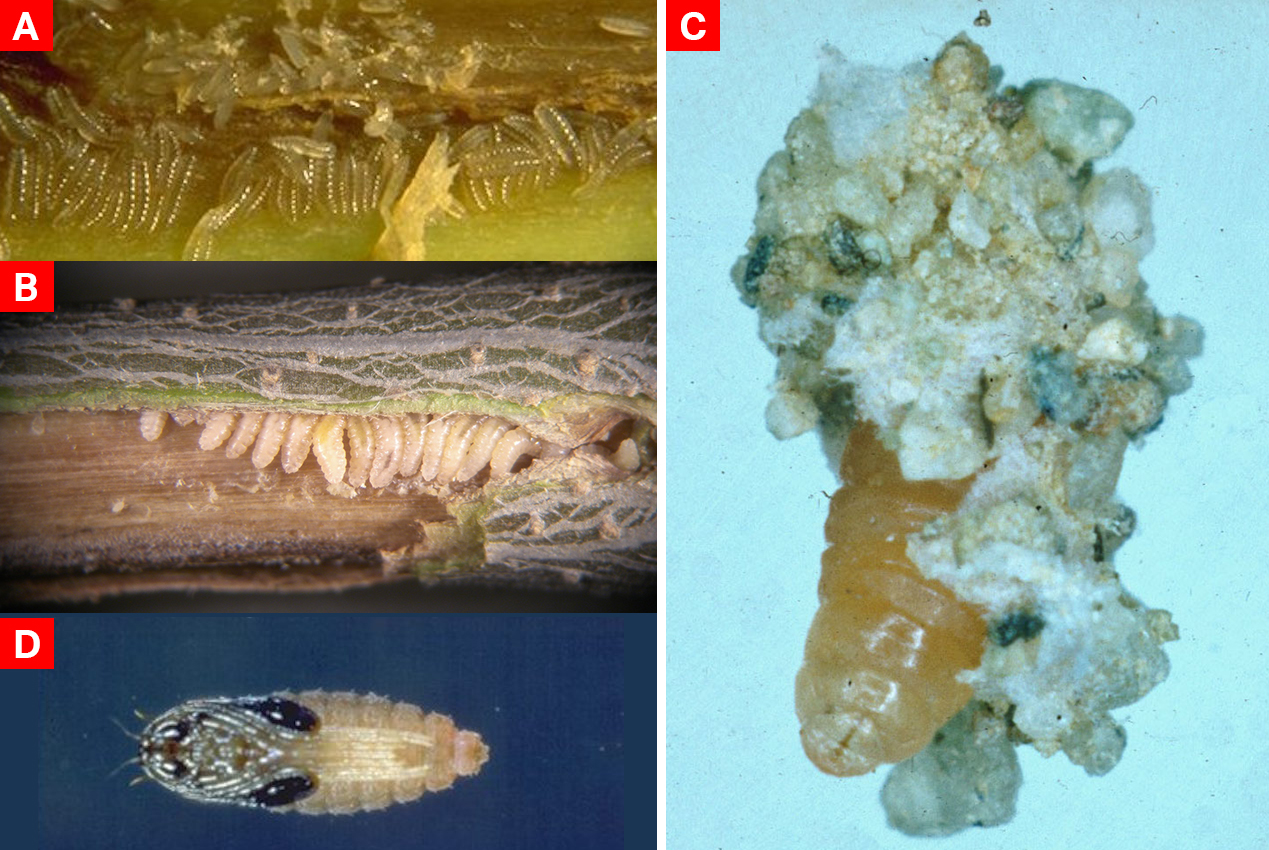
Presenta notevole dimorfismo sessuale: la femmina ha i segmenti dell’addome di colore arancione e all’estremità mostra un caratteristico ovopositore di sostituzione telescopico che quando estroflesso è lungo quanto tutto l’addome; il maschio, invece, ha l’addome scuro e, all’estremità, presenta un’armatura genitale a forma di forcipe (foto 1). Le antenne del maschio sono significativamente più lunghe e complesse rispetto a quelle delle femmine anche se il numero di antennomeri è lo stesso.
Stadi pre-immaginali di sviluppo
L’uovo appena deposto è quasi trasparente, ha forma ovoidale allungata ed è molto piccolo (0,20-0,25 mm). È solitamente deposto in gruppi più o meno numerosi.
La larva, come l’uovo semitrasparente alla schiusura, assume poi durante lo sviluppo una colorazione arancio per misurare a maturità 3-4 mm di lunghezza; presenta piccolissime antenne bisegmentate e un apparato boccale modificato, fortemente ridotto rispetto al masticatore classico, atto alla suzione grazie a minute mandibole stiliformi.
Lo sviluppo larvale passa attraverso tre età di cui la seconda e la terza sono, come in tutta la famiglia, tipicamente caratterizzate dalla presenza a livello del protorace di una particolare appendice, definita spatola sternale (foto 2 A, B, C).
La pupa matura di colore nerastro al capo, al torace e agli astucci alari, e arancione all’addome, è di tipo exarato e misura circa 3-4 mm (foto 2 D). Come quella di molti cecidomiidi possiede nella sua parte anteriore processi e setole atti a permettere all’adulto farato di emergere dal bozzoletto d’impupamento grazie alla rotazione dell’astuccio pupale su se stesso e alla conseguente perforazione dell’involucro sericeo (Bagnoli, oss. pers.).
Riproduzione e dinamica di popolazione
La specie si riproduce sicuramente per anfigonia (riproduzione sessuata), sebbene presenti un rapporto tra sessi che, da rilievi di laboratorio su materiale prelevato in natura, risulta fortemente sbilanciato a favore delle femmine.
Il cecidomiide è polivoltino con la possibilità di svolgere nei nostri ambienti da 2 a 4 generazioni, più o meno accavallate per anno, in funzione soprattutto delle condizioni microclimatiche e più precisamente di quelle relative all’umidità dell’aria e del terreno, di cui predilige valori elevati.
Da ciò deriva che la dinamica e la consistenza della popolazione nel corso dell’anno sembrano seguire tendenzialmente l’alternanza di periodi secchi (limitanti la specie) e stagioni piovose (favorevoli al moscerino suggiscorza, come pure notoriamente alla mosca delle olive), così come è successo nelle annate 2013-2014 e 2017-2018. Lo svernamento della specie è assicurato dalle larve quiescenti nel terreno o meno frequentemente, almeno in parte, da quelle rimaste nelle aree subcorticali di sviluppo, dei rametti.
Condizione fondamentale per la frequenza nel tempo e nello spazio delle ovideposizioni è la disponibilità di soluzioni di continuità della corteccia e/o di superfici di taglio di rametti del diametro di 3-20 mm, in cui la zona cambiale rimanga esposta e raggiungibile dall’estremità dell’ovopositore della femmina.

In effetti, se le condizioni microclimatiche lo consentono, gli adulti sono presenti durante tutta la buona stagione e mostrano la capacità di sfruttare a scopo riproduttivo gran parte dei siti idonei all’ovideposizione, tra i quali ferite da grandine, lesioni da freddo, ferite di ovideposizione da parte di Cicadidae (foto 3) e altri Hemiptera, ma non meno frequentemente abrasioni meccaniche per operazioni di cimatura e raccolta, e tagli di potatura, specialmente in vivaio.
A seguito delle gelate verificatesi in Toscana a fine febbraio 2018, si è reso poi palese da giugno in avanti il diffuso insediamento di popolazioni larvali del dittero nei siti subcorticali di rametti e branchette portanti screpolature dal freddo subito.
Bio-ecologia
Indagini di laboratorio e di campo svolte in anni e oliveti diversi delle province di Siena e Firenze, hanno permesso di stimare che da aprile a ottobre una parte almeno della popolazione completa il ciclo di sviluppo da uovo ad adulto in 35-50 giorni (Bagnoli, 1982; Bagnoli et al., 2007, 2014).
In sintesi il ciclo può essere schematizzato come di seguito. Durante la buona stagione gli adulti neosfarfallati, maturano rapidamente le gonadi, quindi si accoppiano e le femmine attratte verosimilmente da cairomoni associati a lesioni della corteccia, intercettano siti idonei all’ovideposizione, caratterizzati, come sopra si è detto, dalla presenza di porzioni di cambio esposte (v. grafico).
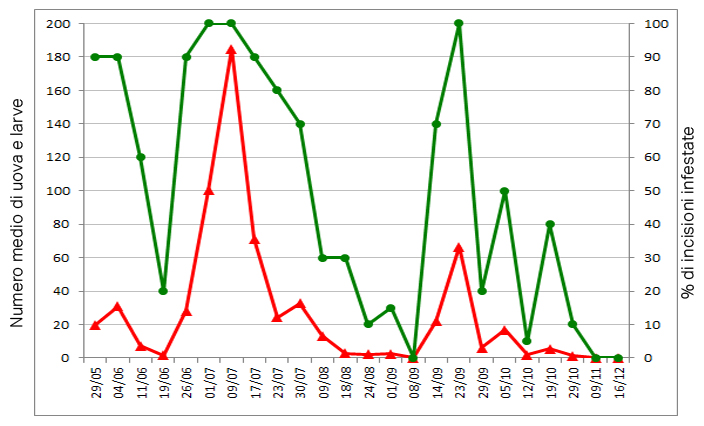
La femmina distendendo l’ovopositore lo inserisce nella lesione corticale e depone le uova in gruppi più o meno numerosi. A completamento dello sviluppo embrionale, della durata di qualche giorno, schiudono le larve che con comportamento pseudogregario, allineate e in contatto fra loro (plesiotropismo), svolgono la loro attività trofica a carico verosimilmente del tessuto cambiale e floematico. Detto comportamento “plasmofago” causa lo scollamento della “corteccia” dal “cilindro centrale” ed è per questo che nel caso specifico, non trattandosi di escavazione da apparato boccale masticatore, è più opportuno parlare di “pseudogalleria” che di “galleria”, o di “galla”, come nel caso di molte confamiliari, quali ad esempio Dasineura oleae e Vitisiella oenephila , che portano con diritto la definizione inglese “gall midges”, genericamente attribuita a tutta la famiglia.
Estremamente difficile, anche in laboratorio, è il reperimento delle esuvie nei siti di sviluppo larvale. A maturità, condizioni fisiche e microclimatiche permettendo, la larva fuoriesce dalla pseudogalleria per guadagnare il suolo dove costruisce un bozzoletto di seta e granelli di terra in cui, o immediatamente o a tempo debito, si trasforma in pupa per proseguire lo sviluppo fino ad adulto.
Detto ciò, fase chiave della specie è quella della larva matura che a seconda della disponibilità di soluzioni di continuità della corteccia interessata dall’infestazione e dell’umidità del suolo, può decidere di rimanere all’interno della pseudogalleria, in attesa si aprano dei varchi per la fuoriuscita dalla stessa, oppure di abbandonarla, per poi, una volta nel terreno, continuare lo sviluppo impupandosi all’interno di un bozzoletto, oppure assumere una tipica forma a C, convessa ventralmente ed entrare in uno stato di quiescenza.
La popolazione larvale del cecidomiide è combattuta in natura da almeno tre categorie di antagonisti:
- predatori, rappresentati essenzialmente da Pyemotes spp. (Acari Pyemotidae);
- ectoparassitoidi, quali Eupelmus spp. (Hymenoptera Chalcidoidea Eupelmidae);
- endoparassitoidi, come Platygaster spp. e Leptacis spp. (Hymenoptera Platygastroidea Platygasteridae) (foto 4) (Bagnoli et al., 2014).

Danni negli oliveti

A prescindere dalla varietà di olivo interessata, i sintomi iniziali dell’attacco su piante adulte consistono in depressioni brunastre di porzioni della corteccia di 1-4 cm2 dovute alla nècrosi dei tessuti conseguente allo sviluppo della pseudogalleria cui danno luogo le larve gregarie plasmofaghe (foto 5).
Nei casi in cui la pseudogalleria arrivi ad avvolgere l’intero rametto, questo è destinato a seccare insieme a tutta la sua parte distale (foto 6).
All’infestazione fa di solito seguito, almeno in oliveti del Veneto e della Toscana, una infezione del legno da parte di funghi del genere Libertella (Xylariales Diatrypaceae) che comporta in genere nel periodo invernale la rottura della branchetta in corrispondenza dell’attacco.

In anni più o meno recenti il cecidomiide è stato oggetto di osservazioni di campo anche per l’impressione diffusa di una recrudescenza dei suoi attacchi soprattutto in Italia meridionale.
Se nei decenni passati i sintomi di disseccamento dei rametti dovuti agli attacchi da parte del dittero apparivano almeno in parte convergenti con i sintomi di verticilliosi, in anni recenti, gli stessi sintomi hanno costituito motivo di preoccupazione anche in ordine alla diffusione del Disseccamento rapido dell’olivo (CoDiRo) dovuto a Xylella fastidiosa subsp. pauca.
In vivaio i maggiori problemi
Nel complesso la dannosità della specie non costituisce in genere un grosso problema negli oliveti commerciali, ma un discorso a parte va fatto per l’impatto che la specie può avere in giovani impianti e soprattutto in ambiente vivaistico.
Infatti, qui si hanno condizioni estremamente favorevoli dal punto di vista microclimatico e dal punto di vista della disponibilità di siti idonei all’ovideposizione conseguenti alle operazioni di taglio dei rami basali per l’impostazione dell’astone.
Indagini svolte alcuni anni or sono nel distretto di Pescia (PT) hanno consentito di stimare che la percentuale di astoni compromessi nel loro valore economico può non di rado raggiungere e superare, nonostante i frequenti interventi fitoiatrici, il 10-15% (Bagnoli et al., 2014).

Al riguardo, nel contesto della filiera vivaistica, le due fasi di maggiore criticità sono il taglio dei rametti basali delle piante innestate di un anno e il taglio dei rametti delle piante in vaso di 5-6 mesi.
Quando questi tagli sono praticati a poca distanza dal fusto, le larve che nascono da uova deposte in corrispondenza del cambio esposto dal taglio, possono facilmente, attraverso la loro contiguità e attività plasmofaga raggiungere l’asse principale e scollare lì la corteccia con conseguenti danni irreversibili alla stessa e al legno sottostante, nonostante il callo di cicatrizzazione una volta eliminata l’infestazione (foto 7).
Strategie di controllo
Anche per il moscerino suggiscorza dell’olivo, elementi fondamentali per la sua gestione sono una corretta diagnosi dei sintomi degli attacchi e determinazione tassonomica dell’agente; un idoneo monitoraggio della popolazione, tenendo presente che a tutt’oggi non sono stati messi a punto dispositivi specifici per la registrazione della dinamica degli adulti e che quindi detto monitoraggio deve avere come “target” la popolazione preimmaginale (eventualmente attraverso la tecnica della predisposizione nell’oliveto di siti artificiali di ovideposizione); una difesa delle giovani piante e delle piante adulte basata su metodologie agronomico-colturali, atte ad evitare la formazione delle più volte citate lesioni corticali.
In vivaio sarà dunque importante:
- praticare operazioni di sanitizzazione;
- effettuare operazioni di taglio il più possibile distante dall’asse dell’astone;
- trattare le superfici di taglio con mastici idonei a impedire l’ovideposizione.
Tutto ciò con più proficui vantaggi rispetto al ripetuto ricorso a trattamenti insetticidi con piretroidi abbattenti nei confronti degli adulti e/o ovo-larvicidi con esteri fosforici citotropici e/o neo-nicotinoidi sistemici.
A quest’ultimo riguardo merita considerare che le larve di R. oleisuga si trovano in un habitat protetto: superiormente dalla corteccia, e verso l’interno dal legno, sicuramente limitato nelle sue funzionalità xilematiche.
Negli oliveti commerciali, le operazioni di sanitizzazione (rimozione delle branchette colpite e applicazione di mastici sulle superfici di taglio) e tutte quelle inerenti una difesa preventiva, ovvero volte a evitare lesioni sulla chioma, rivestono ancor più importanza di quanto non abbiano in vivaio, com’è facile comprendere per la natura dell’agroecosistema e i costi economici e ambientali di eventuali trattamenti insetticidi con molecole di sintesi.
Al riguardo va precisato che a tutt’oggi, relativamente all’Italia e in base alle nostre conoscenze, né si dispone di insetticidi registrati in olivicoltura nei confronti del cecidomiideì, né sono state avanzate agli organi competenti specifiche richieste di deroga.
R. oleisuga è tuttora un insetto di rilevanza economica secondaria in olivicoltura, che tuttavia merita oggi non meno attenzione di altri fitofagi più approfonditamente considerati in entomologia applicata.
I motivi di ciò non derivano dall’interesse degli autori per la specie, ma da due principali fattori, dibattuti di recente anche al di fuori degli ambiti scientifici, accademici e professionali di settore.
Il primo elemento di preoccupazione è quello dei “cambiamenti climatici”, che potrebbero avere ripercussioni significativamente positive nei confronti dei processi di moltiplicazione di una specie che si avvantaggia della presenza di lesioni da grandine nell’oliveto, e che predilige climi caldo-umidi in estate.
Il secondo elemento, anch’esso di forte preoccupazione, è quello che riguarda l’indiscutibile necessaria intensificazione colturale degli oliveti italiani, che, se non condotta in modo prospettico, attraverso la calibrazione areale per areale delle più razionali densità d’impianto e dei più oculati processi di meccanizzazione delle operazioni colturali, potrebbe rendere l’oliveto assai più suscettibile alle infestazioni del cecidomiide ed elevare la specie allo status di “pest”.
Di fronte a ciò, il monitoraggio costante, supportato da un’efficiente ricerca e da un’adeguata formazione professionale, costituisce in un certo senso il primo baluardo di resilienza dell’agro-ecosistema oliveto.
*Frigimelica G. et al., IOBC WPRS BULLETIN, 2007, 30(9): 197. **Bagnoli B. et al., IOBC-WPRS Bulletin, 2014, 108: 16.
Bruno Bagnoli, Università della Tuscia, Dipartimento per la Innovazione nei sistemi biologici, agroalimentari e forestali, Viterbo; Elisabetta Gargani, CREA Centro di Ricerca Difesa e Certificazione, Firenze.












